干细胞,被誉为生命的“种子”,它是一种具有自我更新和多向分化潜能的特殊细胞。它们能够不断地自我复制以保持其数量不变,同时在特定条件下还可以分化成身体中的任何类型的细胞。根据其来源和特性的不同,干细胞主要可以分为三大类:胚胎干细胞、间充质干细胞、诱导多能干细胞(Induced Pluripotent Stem Cells, IPSC)。这其中,诱导多能干细胞(iPSCs)被公认为是最安全的“万能”干细胞。

一、IPSC的独特优势
1、 避免伦理争议
胚胎干细胞(ESCs)
· 需要通过销毁早期胚胎获取,涉及伦理争议。
· 在部分国家和地区受到严格监管或限制。
间充质干细胞(MSCs)
· 来源多样(如骨髓、脂肪组织),无伦理争议,但分化潜能有限,无法满足全能性需求。
iPSCs
· 来源于成体细胞(如皮肤或血液),无需胚胎或捐赠组织,完全避免伦理问题。
· 适用于全球范围的研究和临床应用,社会接受度高。
2. 免疫排斥风险
胚胎干细胞(ESCs)
· 需要来自捐赠胚胎,与患者的基因型不匹配,移植后可能引发免疫排斥反应。
· 通常需要配合免疫抑制药物,可能引发副作用。
间充质干细胞(MSCs)
· 免疫调节能力强,但无法满足所有组织的再生需求。
iPSCs
· 可以从患者自身细胞生成,完全个性化治疗。
· 自体来源的细胞可以避免免疫排斥和排异反应,提高治疗安全性和效果。
3. 致瘤性
胚胎干细胞(ESCs)
· 多能性强,但容易在体内形成畸胎瘤(teratoma),需要严格控制其分化方向和分化程度。
间充质干细胞(MSCs)
· 安全,但分化能力有限,无法满足生成所有细胞类型的需求。
iPSCs
· 早期研究中,重编程过程可能导致基因突变或不稳定,增加致瘤风险。
· 随着技术进步(如无整合病毒系统的开发),这些问题正在逐步解决。
· 目前,通过严格分化控制和质量检测,可以显著降低致瘤风险。
4. 多能性
胚胎干细胞(ESCs)
· 分化潜能最强,可生成所有三胚层细胞类型。
· 但难以精准控制其分化,存在潜在安全隐患。
间充质干细胞(MSCs)
· 分化能力局限于间充质细胞系(如软骨、骨、脂肪等),无法满足所有分化需求。
iPSCs
· 与胚胎干细胞几乎相当的多能性。
· 分化方向可控性不断提升,适用范围广泛,可满足多种疾病治疗需求。
5. 技术成熟度和适用性
胚胎干细胞(ESCs)
· 虽然研究历史悠久,但由于伦理和免疫问题,其临床应用受到限制。
间充质干细胞(MSCs)
· 技术较成熟,已广泛应用于免疫调节和组织修复,但用途受限。
iPSCs
· 随着重编程技术的优化(如使用非病毒载体或小分子化合物),iPSCs 的生产过程更加安全。
· 可广泛应用于基因治疗、再生医学、药物筛选等领域,展现出巨大的应用潜力。
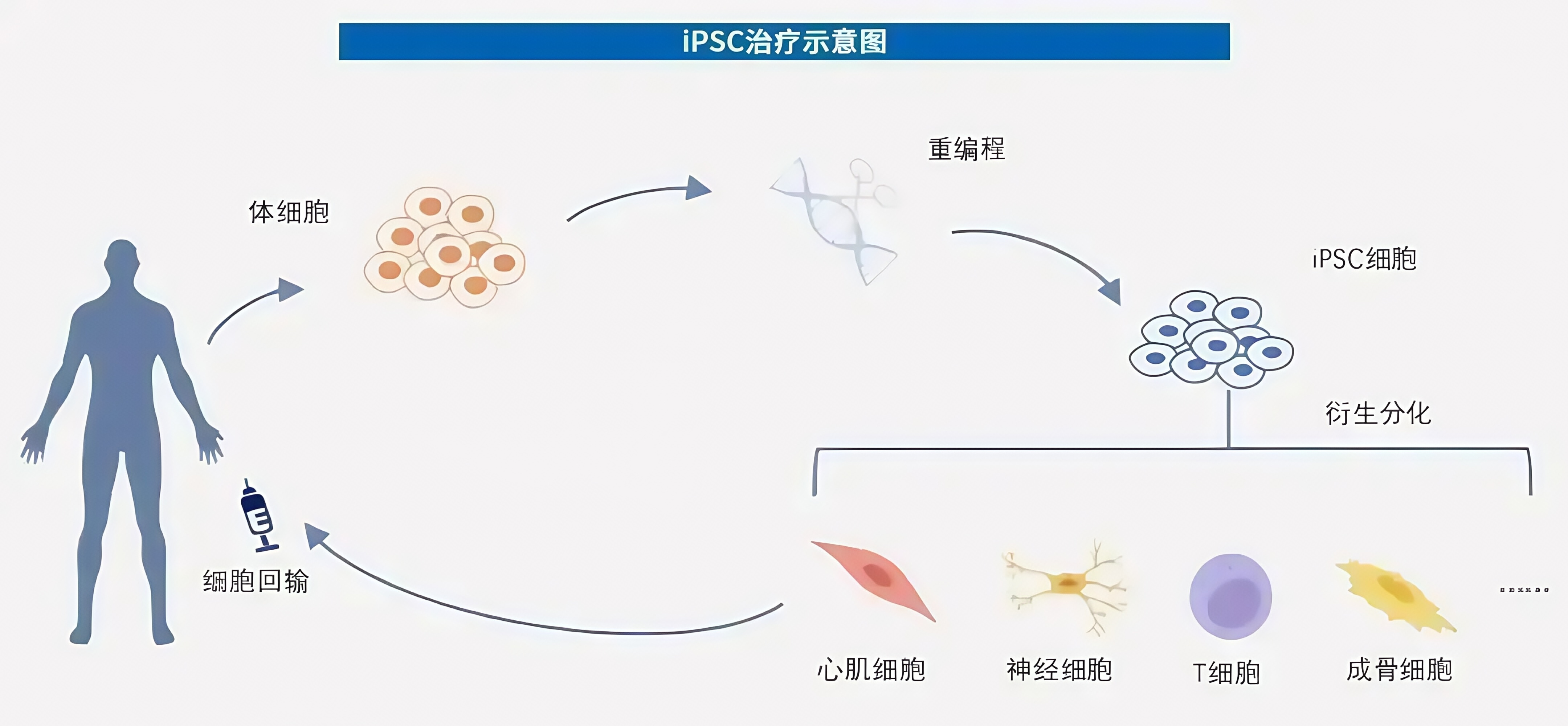
二、IPSC技术带来的影响
1. 基础科学研究中的突破
(1)细胞命运的重新定义
· iPSCs技术证明了分化细胞可以被“重编程”为多能状态,这颠覆了传统生物学中“细胞分化不可逆”的观念。让人类实现“返老还童”的梦想不再遥不可及。
· 为理解细胞命运决定、重编程机制和基因调控网络提供了全新视角。
(2)转录因子重编程技术
· 山中伸弥及其团队于2006年发现的核心转录因子组合(Oct4、Sox2、Klf4、c-Myc)成为重编程的基础。
· 后续开发了非病毒载体技术(如mRNA、蛋白递送等),提高了iPSCs技术的安全性。
虽然我国起步较晚,但这方面已经取得了较为领先的突破。
(3)三胚层分化能力
· iPSCs的多能性与胚胎干细胞(ESCs)相似,能够分化为内胚层(肝细胞、胰岛细胞等)、中胚层(心肌细胞、骨骼细胞等)和外胚层(神经元、皮肤细胞等)来源的所有细胞类型,为再生医学和发育生物学研究提供了重要模型。
2. 再生医学领域的成就
(1)器官和组织再生
· 视网膜色素上皮细胞移植:2014年,日本成功开展全球首例基于iPSCs的临床试验,将iPSCs分化为视网膜色素上皮细胞,用于治疗年龄相关性黄斑变性(AMD)。
· 心肌细胞移植:利用iPSCs分化为心肌细胞,修复心肌梗死造成的心脏损伤。
· 神经元移植:iPSCs分化为多巴胺神经元,成功用于动物模型的帕金森病治疗。
(2)类器官培养
· iPSCs技术结合3D培养系统,成功构建了多种“类器官”(organoids),包括脑类器官、肝类器官、肾类器官等。这些类器官不仅能模拟人类器官的结构和功能,还为疾病研究和药物开发提供了工具。
3. 疾病研究与个性化治疗
(1)疾病建模
遗传病模型:利用患者细胞生成iPSCs,并分化为病变相关细胞,科学家已构建了多种疾病模型,如:
神经退行性疾病(帕金森病、阿尔茨海默病、ALS)。
心血管疾病(长QT综合征、心肌病)。
代谢疾病(糖尿病)。
肿瘤研究:利用肿瘤患者的iPSCs,研究癌细胞分化及其进展机制。
(2)药物筛选
使用iPSCs分化得到的特定细胞类型,模拟人体病理状态,测试药物疗效和毒性。例如:
心脏毒性测试:用iPSCs衍生心肌细胞评估候选药物对心脏的副作用。
神经疾病药物开发:通过帕金森病患者的iPSCs,测试新型神经保护剂。
(3)基因治疗结合
与CRISPR基因编辑技术结合,iPSCs被用于修复遗传疾病的突变基因,并分化为健康细胞用于移植。
例如,镰状细胞贫血和杜氏肌营养不良症的基因修复研究已取得显著进展。
值得着重说明的是,我国科学家利用IPSC技术在一些疾病的临床研究中,已经取得了举世瞩目的成绩。比如:一型、二型糖尿病,神经退行性疾病、镰状细胞贫血症等。
4. 免疫细胞治疗的突破
(1)CAR-T疗法
· 利用iPSCs分化生成通用型T 细胞,并通过基因改造使其表达嵌合抗原受体(CAR),开发出下一代CAR-T细胞,用于癌症治疗。
· iPSCs技术为批量生产免疫细胞提供了标准化解决方案。
(2)NK细胞和巨噬细胞
· 通过iPSCs生成自然杀伤细胞(NK细胞)和巨噬细胞,用于治疗难治性实体瘤和感染性疾病。
5. 药物开发和毒性测试
(1)个性化药物筛选
· 从患者体内提取细胞生成iPSCs,分化为疾病相关细胞,用于筛选最适合患者的药物。
· 例如,针对囊性纤维化患者的药物筛选取得了显著效果。
(2)毒性评估平台
· iPSCs衍生的肝细胞、心肌细胞和神经元被广泛用于新药毒性测试,降低了药物在临床试验阶段失败的风险。
6. 动物保护与生态应用
(1)濒危物种保护
· iPSCs技术被用于生成濒危动物的生殖细胞或组织,例如北方白犀牛的人工繁育研究。
(2)农业应用
· iPSCs技术已被用于家畜改良研究,包括优化基因编辑以增强抗病能力或生产效率。
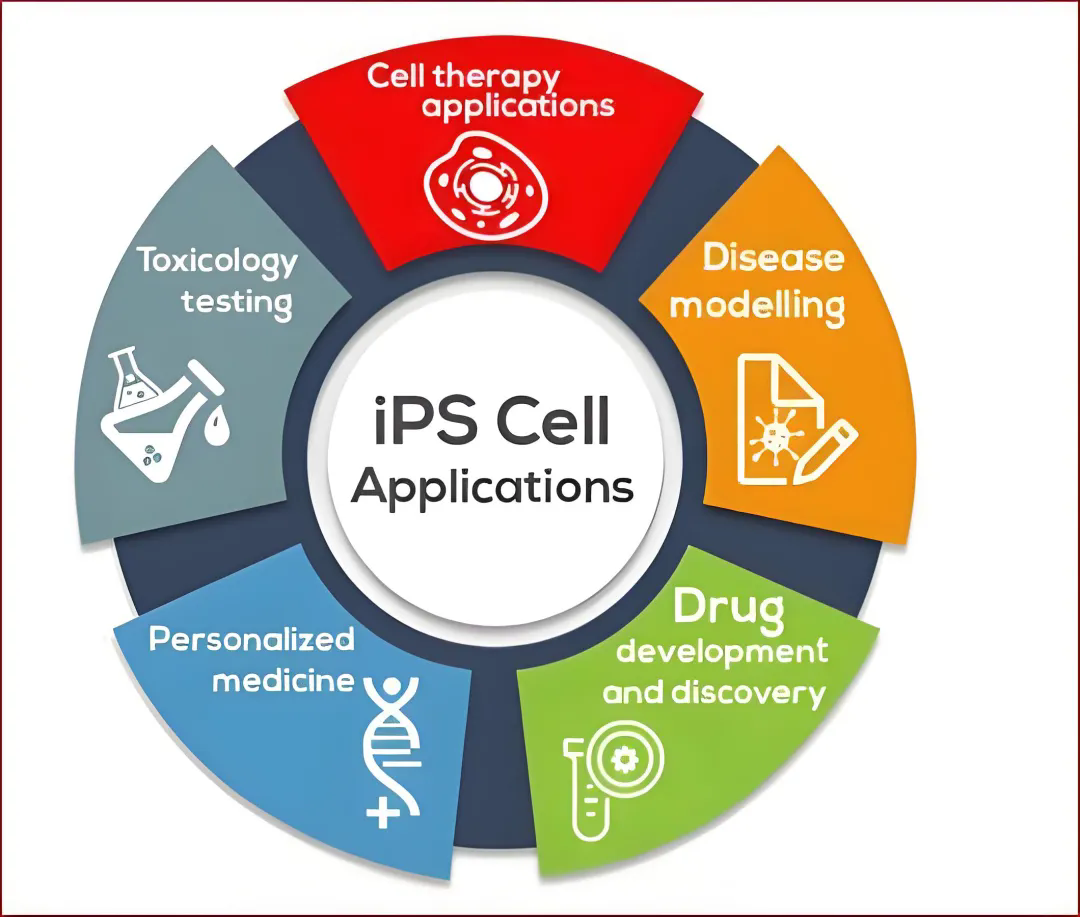
总结
诱导多能干细胞(iPSCs)之所以被认为是“最安全的万能干细胞”,除了可以有效避免伦理争议、降低免疫排斥风险外,更具有广泛的临床应用潜力。并且随着科学技术的不断进步,iPSCs在安全性和应用方面不断取得突破。通过重编程技术,iPSCs不仅为个性化医学、基因治疗、再生医学提供了新的机遇,而且还推动了对疾病机制的研究和新的药物发现。无论是在抗衰保健方面,还是在疾病预防、干预方面都产生了深远的影响,并展现出了强大的生命力和应用范围。因此,是当之无愧的万能细胞!